
Alex Vassilev and Melvin L. DePamphilis. Links between DNA replication, stem cells and cancer. Genes 2017, 8(2), 45; doi:10.3390/genes8020045
Рак можно категоризировать в две группы: рак, частота которого увеличивается с возрастом, и рак, следующий из ошибок в процессе развития млекопитающих. Первая группа связана с ДНК репликацией и накоплением генетических мутаций, которые наблюдаются в процессе пролиферации онтогенетически приобретенных стволовых клеток, инициирующих и поддерживающих ткани и органы. Эти мутации, которые являются результатом ошибок репликации ДНК и также экологических инсультов, делятся на две категории; мутации, которые инициируют канцерогенез, и геном-дестабилизирующие мутации, которые способствуют анеуплоидии через избыточную геномную дупликацию и хроматидную миссегрегацию. Повышенная геномная нестабильность приводит к ускоренной клональной эволюции, приводящей к появлению более агрессивных клонов с повышенной лекарственной резистентности.
Вторая группа раковых заболеваний, называемых герминативными опухолями, является результатом ошибочной локализации плюрипотентных стволовых клеток во время раннего развития. Во время нормального развития плюрипотентные стволовые клетки, появляющиеся у ранних эмбрионов, приводят к зарождению всех клеточных линий у эмбрионов и взрослых, но в случае их перемещения в эктопические области, они продуцируют опухоли. Примечательно, что плюрипотентные стволовые клетки, как и многие раковые клетки, зависят от протеина геминин (Geminin) для предотвращения избыточной репликации ДНК от инициирования повреждение ДНК-зависимого апоптоза. Эта связь между контролем репликации ДНК во время раннего развития и герминативными опухолями показывает, что геминин является потенциальной химиотерапевтической мишенью в эрадикации раковых прогениторных клеток.
Рак
Что такое рак?
Термин «рак» описывает опухоли и другие формы аномального роста ткани (неоплазия). В целом, рак обладает 10 признаками: самодостаточность в ростовых сигналах, нечувствительность к антиростовым сигналам, уклонение от апоптоза, неограниченная пролиферация, устойчивый ангиогенез, инвазия в окружающие ткани и метастазы в отдаленные области, использование аномальных метаболических путей для генерации энергии (например, гипотеза Варбурга), уклонение от иммунной системы, нестабильность генома и хроническое воспаление. Таким образом, раковые клетки отличаются от нормальных клеток в их способности пролиферировать в условиях, невозможных для нормальных клеток, а также мигрировать и инициировать рост в новых локализациях.
Какова вероятность развития рака?
Рак занимает второе место после болезней сердца как ведущая причина смерти в США и во всем мире. На долю рака приходится 68% всех смертей от неинфекционных заболеваний во всем мире и 23% всех смертей в США. В 2016 году у около 1/200 человек будет диагностирован раком; около 35% умрут от болезни (Centers for Disease Control). Рак можно разделить на три группы по возрасту [3]. После половой зрелости заболеваемость раком экспоненциально возрастает с возрастом, так что около 1% мужчин и женщин переносят рак к 60-летнему возрасту (рис. 1A). Таким образом, большинство типов рака — это болезнь старения, за который ответственны, главным образом, накопление генетических мутаций и хромосомных аберраций, хотя другие процессы, связанные со старением, также могут вносить вклад. Например, аккумуляция стареющих клеток и высокое воспаление, по-видимому, способствуют началу и росту рака. Однако частота определенных онкозаболеваний ингибируется с возрастом (рис. 1В). Старение сосудов и снижение уровней гормона роста, по-видимому, редуцируют инициирование и рост рака.
Частота рака щитовидной железы, шейки матки и матки постоянна примерно в 30 лет, а частота тонзиллярного рака в основном ограничена людьми в возрасте около 60 лет. Однако наиболее яркими являются герминативные опухоли, которые наблюдаются прежде всего у новорожденных, подростков и молодых людей. Частота тестикулярного рака, например, достигает пика в возрасте около 35 лет, когда он встречается у примерно 0,01% мужчин (рис. 1С).

Рисунок 1. Инцидент различных типов канцера — функция возраста. Частота рака на 100 000 человек как функция возраста населения Соединенных Штатов за 10-летний период 1999-2009 годов [3]. Данные для мужчин и женщин объединены, за исключением указанных случаев. (A) Возраст-зависимые раковые заболевания представлены раком желудка, толстой кишки, легкого, молочной железы (женщины), предстательной железы, мочевого пузыря, головного мозга, лимфом, лейкозов и меланомы; (B) Возраст-ингибируемые раковые заболевания представлены раком миндалин (фиолетовый), щитовидной железы (светло-зеленый), шейки матки и матки (темно-зеленый); (C) Герминативные неоплазии представлены раком яичка.
Каковы истоки рака?
Есть две гипотезы о происхождении канцера человека. Первая, рак — следствие генетических мутаций, которые или наследуются, или приобретаются вследствие ошибок в ДНК репликации и средовых нарушений [4]. Эта теория объясняет корреляцию между старением и риском развития рака [5]. Вторая теория состоит в том, что рак следует из раковых стволовых клеток (CSC), которые сохраняют способность бесконечно пролиферировать без потери их способность инициировать бесконтрольный рост, ведущий к раку [6,7]. Все раковые клетки могут размножаться в условиях, невозможных для нормальных клеток, но только CSC могут инициировать опухоль de novo. Окончательное доказательство существования CSC было впервые сообщено для лейкемии [8,9], а затем распространено на солидные опухоли. Эти две теории не являются взаимоисключающими, поскольку CSC могут возникать во время развития млекопитающих путем накопления генетических мутаций. Альтернативно, CSC могут представлять активацию покоящихся стволовых клеток, которые пробуждаются в чужеродной среде (в эктопическом локусе) и отвечают на пролиферативные и миграторные сигналы, для ответа на которые они были не запрограммированы.
Внутренние против внешних факторов риска
Хорошо известно, что частота рака среди различных тканей и органов распределяется неравномерно как во времени, так и в пространстве; в некоторых типах тканей рак человека развивается в миллионы раз чаще, чем других типах тканей. Непонятно, что вклад врожденных рисков для развития конкретного рака в течение жизни, например, случайных мутаций, которые происходят во время пролиферации стволовых клеток, против вклада внешних рисков, таких как вирусы, химические канцерогены и радиация.
Путем математического анализа Томасетти и Фогельштейн (Tomasetti and Vogelstein) пришли к выводу, что риск развития рака на протяжении всей жизни сильно коррелирует с общим числом делений нормальных самообновляющихся клеток, поддерживающих гомеостаз ткани [5]. Эти тканевые прогениторные клетки должны образовываться из тканеспецифических стволовых клеток, продуцируемых во время эмбрионального развития. Прижизненный риск развития рака в течение жизни был рассчитан против числа делений стволовых клеток в 31 типе тканей, для которых были количественно оценены стволовые клетки (рисунок 2).
Результаты показали резкую корреляцию между этими двумя параметрами на пять порядков. Более того, они показали, что рак с известными наследственными факторами риска чаще встречается в некоторых тканях, чем в других. Например, мутации гена семейного аденоматозного полипоза (Familial Adenomatous Polyposis Coli) в 30 раз более вероятно вызывали колоректальный рак, чем рак двенадцатиперстной кишки, по-видимому, вследствие того, что толстому кишечнику требуется ~ 150-кратное количество делений стволовых клеток, чем двенадцатиперстной кишке. Напротив, внешние факторы риска, такие как курение, вирус гепатита С или папилломавирус человека, значительно повышают риск развития рака в легких, печени и головы/шеи соответственно. Например, у курящх людей в 18 раз чаще развивается рак легких.
Эти результаты показывают, что только 30% вариаций риска рака среди тканей объясняются факторами окружающей среды или наследственными предрасположенностями. Большинство типов рака являются результатом случайных мутаций, возникающих при репликации ДНК в нормальных стволовых клетках, необходимых в процессах развития и поддержания тканей.
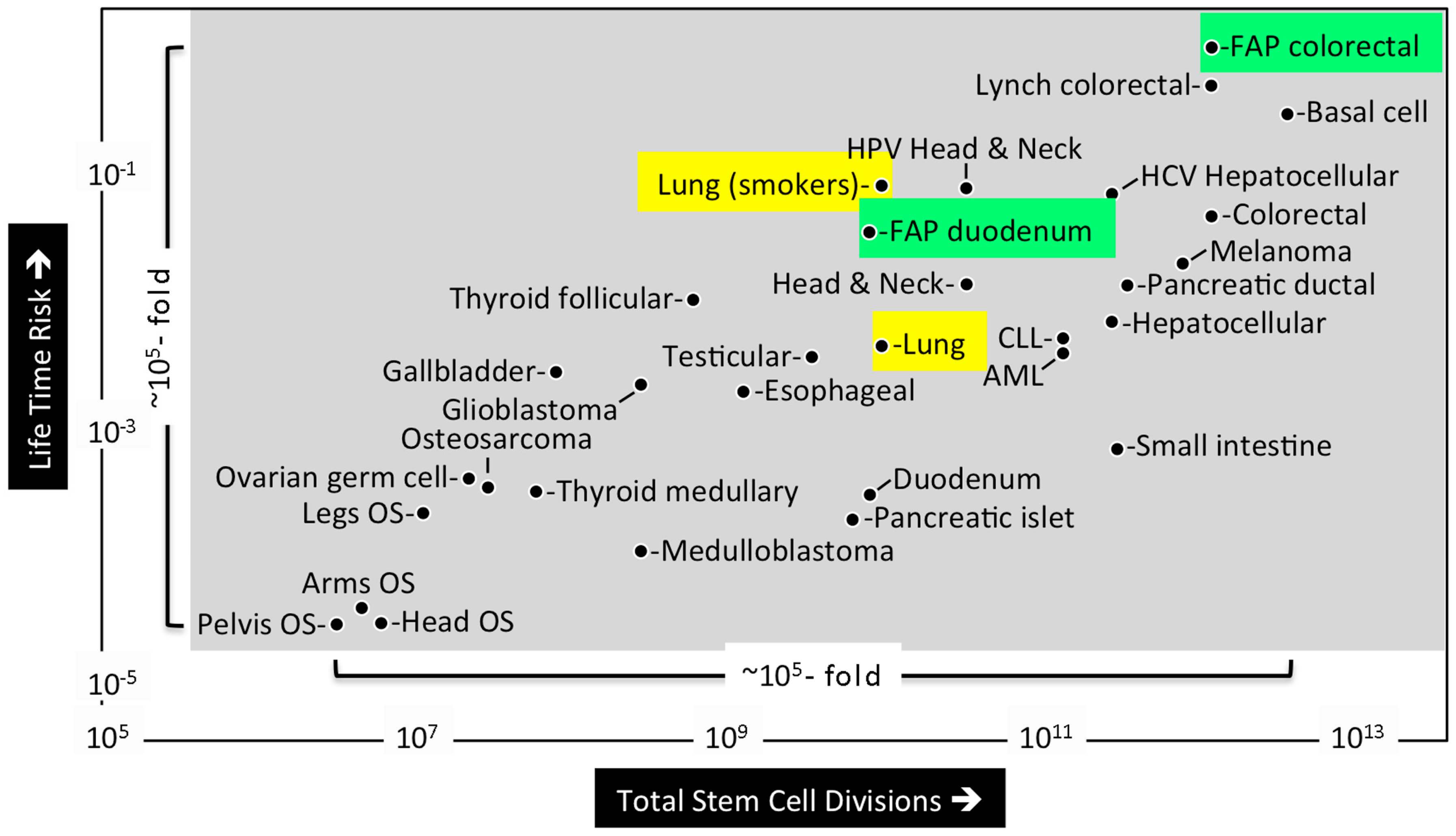
Рисунок 2. Различия в риске развития рака среди разных тканей можно объяснить общим числом делений стволовых клеток в этих тканях [5]. Общее число делений клеток в течение среднего времени жизни человека, умноженное на количество стволовых клеток в ткани (ось х), было нанесено против прижизненного риска развития рака этого типа ткани (ось y) для 31 типа тканей, в которых было определено количественно стволовых клеток. Только на 9 из 31 канцера значительно повлияли на внешние факторы (например, курение (желтый)). Наследственные факторы риска встречались чаще в определенных тканях (например, мутации FAP гена (зеленый)). Сокращениями являются остеосаркома (OS), семейный аденоматозный полипоз (FAP), вирус гепатита С (HCV), папилломавирус человека (HPV), хроническая лимфоцитарная лейкемия (CLL) и острый миелоидный лейкемий (AML).
Ву (Wu) и коллеги пришли к выводу, что корреляция между делением стволовых клеток и риском рака не проводит различия между внутренними и внешними факторами [4]. Они пришли к выводу, что скорости мутаций, вызванных внутренними факторами, не могут объяснить наблюдаемые риски рака и что от 70% до 90% распространенных видов рака вызваны внешними факторами.
Для решения этой головоломки, Чжу (Zhu) и его коллеги картировали частоту рака в различных органах новорожденных и взрослых мышей [15]. Их стратегия заключалась в том, чтобы обойти необходимость учитывать внешние факторы, сопоставляя судьбу стволовых клеток, которые уже содержали онкогенные факторы риска, тем самым выявляя только роль канцерных драйверных мутаций, вместе с количеством делений стволовых клеток, которые наблюдались в каждом органе с течением времени. Их результаты показали, что риск развития рака у человека в значительной степени связан с прижизненной генеративной способностью мутантных клеток (рис. 3). Если стволовая клетка находилась в состоянии покоя, она не вызывала рака, независимо от наличия или отсутствия онкогенных мутаций. Если стволовые клетки подвергались множественным генерациям, частота рака в значительной степени зависела от количества делений стволовых клеток, а также от наличия онкогенной драйверной мутации. Это соотношение было истинным в присутствии множественных генотипов и независимо от стадии развития, сильно поддерживая представление о том, что частота пролиферации стволовых клеток диктует риск развития рака среди органов, как это было предложено Томасетти и Фогельштейном.

Рисунок 3. Генерирующая способность стволовых клеток органа детерминирует прижизненный риск развития канцера в этом органе [15]. Кроме того, внешние факторы специфично конвергируют на стволовые клетки с индукцией мутаций и/или повреждением тканей, что провоцирует пролиферативную репарацию. Ткань-специфическая восприимчивость стволовых клеток к индуцированным мутациям и их врожденная или повреждение-индуцированная пролиферативная способность создает «идеальный шторм», который в конечном итоге определяет риск возникновения рака в органах.
Тем не менее внешние факторы, такие как повреждение тканей, могут играть ведущую роль. Онкогенные мутации, которые были введены в стволовые клетки нормальной печени взрослых, были недостаточными для индуцирования опухолей, поскольку эти клетки находились в покое. Однако, когда частичная гепатэктомия индуцировала клеточную пролиферацию, и трансформированные стволовые клетки продуцировали рак.
Таким образом, канцерогенные свойства определенных внешних факторов могут быть связаны исключительно с индукцией ими локального повреждения тканей и активации восстановления клеток, тем самым ускоряя клеточную пролиферацию, которая способствует трансформации клеток. В этой модели риск рака органов определяется сочетанием факторов: врожденной пролиферативной способностью популяции стволовых клеток, инцидента локального повреждения тканей, вызывающего клеточную пролиферацию, и восприимчивости этих клеток к мутациям, которые могут трансформировать их в канцер.
Клональная эволюция канцера
За редким исключением спонтанные опухоли происходят от единичной клетки. Тем не менее, во время клинического диагноза большинство опухолей человека демонстрируют поразительную гетерогенность, такую как экспрессия рецепторов клеточной поверхности, пролиферация и ангиогенез, для которых имеются убедительные доказательства сосуществования генетически дивергентных клонов раковых клеток в опухолях [ 16].
Такая гетерогенность опухоли может быть идентифицирована различиями в морфологии клеток, геномной ДНК и профилях экспрессии генов, которые позволяют классифицировать опухоли в подтипы. В «модели клональной эволюции» [17] типы мутаций будут меняться по мере развития рака, так что отдельные раковые клетки станут более трансформированными и агрессивными. Фактически, ДНК секвенирование у онкобольных подтвердило последующее и независимое накопление генетических мутаций при метастазировании исходной опухоли [18,19]. Филогенетический анализ мутаций в отдельных метастатических очагах, предполагает разветвленную ветвистую эволюцию опухоли с 63-69% всех соматических мутаций, которые не обнаруживаются в каждой опухолевой области [18].
ДНК репликация и канцер
Главная директива, которая управляет циклом митотического деления клеток, состоит в том, что ядерный геном дублируется только один раз, когда клетка делится [20]. Надежные нормативные сети обычно ограничивают репликацию ядерной ДНК одним полным дублированием генома каждое деление (рис. 4).
Сборка и активация протеинов репликации в селективных областях вдоль ядерной ДНК ограничивается M→G1 и G1→S транзитом, соответственно. Источник разрешения активно предотвращается в течение S и ранней M-фазы, и механизмы действуют во время фазы G2 через цитокинез, чтобы гарантировать, что каждая дочерняя клетка получает одно ядро с двумя полными наборами хромосом.

Рисунок 4. Цикл митотического деления клеток млекопитающих состоит из пяти фаз. В течение G1-фазы клетка увеличивается в размерах и разрешает начало своей репликации путем сборки предрепликационных комплексов в процессе подготовки к репликации ядерной ДНК (называемой «лицензирование начала»). S-фаза начинается, когда лицензированные начала репликации далее упорядочиваются в прединициирующие комплексы, которые активируются двумя отдельными протеинкиназами для инициирования двунаправленной репликации ДНК. G2-фаза представляет собой короткий период времени между окончанием репликации ядерной ДНК и началом митоза (называемой М-фазой). Митоз — это разделение гомологичных пар хромосом в два идентичных ядра, каждый содержащий 2N ДНК. Цитокинез — это разделение бинуклеатной клетки на две клетки. Для гарантии, что дочерние клетки получают одну и только одну копию генома, разрешение начала ограничивается M→G1 тразитом, а активация начала ограничивается S-фазой.
Исключения из этого правила являются редкими, и те, которые действительно происходят, регулируются в целях продукции окончательно дифференцированных, жизнеспособных, непролиферирующих клеток путем мейоза, неудавшегося цитокинеза, эндомитоза или эндорепликации (бокс 1).
|
Вставка 1. Онтогенетически регулируемые изменения в плоидности Мейоз — После репликации ДНК следуют два раунда митотического деления клеток в отсутствие репликации ядерной ДНК с генерацией четырех клеток, каждая из которых имеет половину числа хромосом в качестве исходной родительской клетки. Гаплоидные зародышевые клетки (сперматозоиды и ооциты) возникают через диплоидные зародышевые клетки, подвергающиеся мейозу. Неудавшийся цитокинез — Миокардиоциты и гепатоциты являются результатом неудавшегося цитокинеза, который продуцирует двуядерную тетраплоидную клетку (одна клетка с двумя ядрами, каждая с содержанием 2N ДНК) [21,22]. Бинуклеатные тетраплоидные клетки могут завершить успешный клеточный цикл плюс митоз, генерируя одноядерные тетраплоидные клетки, где каждое ядро — 4N. Повторение этих событий объясняет редкие октоплоидные и гексадекаплоидные клетки. Эндомитоз — Мегакариоциты — клетки костного мозга, которые ответствене за продукцию тромбоцитов, необходимых для свертывания крови. Тромбопоэтин промотирирует рост и развитие мегакариоцитов из их прекурсоров,мегакариобластов, инициируя эндомитоз, повторные циклы ДНК репликации, сопровождаемой входом в митоз без цитокинеза. Это приводит к единственному многодольчатому ядру, содержащему кратные 4N ДНК (например, 8N, 16N, 32N, и т.д.). Это, в конечном счете, ведет к формированию тромбоцита. Эндомитоз является результатом дефекта в позднем цитокинезе, который влечет неполное формирование борозды расщепления, сократительное кольцо, состоящее из миозина II и F-актина, которое генерирует механические силы, необходимые для разделения клеток [23, 24]. Для полиплоидизации, выходящей за пределы 4N [25], требуется пониженная регуляция ECT2 гена, который необходим для цитокинеза. Кроме того, повышение регуляции компонентов G1-фазы, таких как циклин E, может иметь важное значение для развития множественных циклов эндомитоза [26]. |